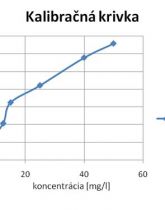
Meranie: Adsorpcia v kolóne (Laboratórne cvičenie z biotechn. procesov č. 4)
Skryť detaily | Obľúbený- Kvalita:82,2 %
- Typ:Meranie
- Univerzita:Technická univerzita v Košiciach
- Fakulta:Hutnícka fakulta
- Kategória:Technika
- Podkategória:Hutníctvo
- Predmet:Biotechnologické procesy
- Ročník:4. ročník
- Rozsah A4:3 strán
- Zobrazené:1 580 x
- Stiahnuté:14 x
- Veľkosť:0,1 MB
- Formát a prípona:MS Office Word (.doc)
- Jazyk:slovenský
- ID projektu:13801
- Posledna úprava:26.07.2021
Teória
Adsorpcia (z lat. adsorbere) je viazanie plynnej alebo kvapalnej (rozpustenej) látky povrchovou vrstvou inej, pevnej látky. Príslušné sloveso znie „adsorbovať“. Opakom adsorpcie je desorpcia.
Zovšeobecnene sa pod adsorpciou rozumie samovoľné zvyšovanie koncentrácie látok na fázovom rozhraní, najčastejšie na rozhraní tuhej a plynnej alebo tuhej a kvapalnej fázy, sprevádzané uvoľnením adsorpčného tepla.
Dôležitou vlastnosťou adsorpcie je závislosť rovnovážneho naadsorbovaného množstva látky od koncentrácie, respektíve od teploty. Adsorpcia umožňuje oddelenie zložiek ktoré sa v zmesi vyskytujú v nízkych koncentráciách. Napríklad adsorpciou na aktívnom uhlí (náš prípad) možno zo vzduchu veľmi účinne oddeliť malé množstvá organických rozpúšťadiel. Adsorpcia sa používa pri spracovaní ropy (sušenie, rafinácia), na odfarbovanie tukov, rafináciu cukru, pri úprave vody, na sušenie plynov, vo farmaceutickom priemysle. Z plynných zmesí sa adrorbciou získavajú vzácne plyny, pary rozpúšťadiel a odstraňujú sa toxické prímesi.
Klasifikácia
Podľa povahy väzieb medzi povrchom a adsorbovanými molekulami sa hovorí buď o fyzikálnej adsorpcii alebo chemickej adsorbcii (chemisorpcii).
Fyzikálna adsorpcia
Fyzikálna adsorpcia je vratná, lebo adsorbát je viazaný na povrch adsorbenta slabými medzimolekulovými silami.
Chemisorpcia
Pri chemisorpcii vzniká pevnejšia, najčastejšie elektrochemická väzba medzi adsorbovanou látkou a adsorbentom, pričom sa uvoľní teplo. Na rozdiel od fyzikálne adsorpcie prebieha chemisorpcia pomaly. Výťažok adsorpcie s rastúcou teplotou monotónne klesá.
...
Adsorpcia (z lat. adsorbere) je viazanie plynnej alebo kvapalnej (rozpustenej) látky povrchovou vrstvou inej, pevnej látky. Príslušné sloveso znie „adsorbovať“. Opakom adsorpcie je desorpcia.
Zovšeobecnene sa pod adsorpciou rozumie samovoľné zvyšovanie koncentrácie látok na fázovom rozhraní, najčastejšie na rozhraní tuhej a plynnej alebo tuhej a kvapalnej fázy, sprevádzané uvoľnením adsorpčného tepla.
Dôležitou vlastnosťou adsorpcie je závislosť rovnovážneho naadsorbovaného množstva látky od koncentrácie, respektíve od teploty. Adsorpcia umožňuje oddelenie zložiek ktoré sa v zmesi vyskytujú v nízkych koncentráciách. Napríklad adsorpciou na aktívnom uhlí (náš prípad) možno zo vzduchu veľmi účinne oddeliť malé množstvá organických rozpúšťadiel. Adsorpcia sa používa pri spracovaní ropy (sušenie, rafinácia), na odfarbovanie tukov, rafináciu cukru, pri úprave vody, na sušenie plynov, vo farmaceutickom priemysle. Z plynných zmesí sa adrorbciou získavajú vzácne plyny, pary rozpúšťadiel a odstraňujú sa toxické prímesi.
Klasifikácia
Podľa povahy väzieb medzi povrchom a adsorbovanými molekulami sa hovorí buď o fyzikálnej adsorpcii alebo chemickej adsorbcii (chemisorpcii).
Fyzikálna adsorpcia
Fyzikálna adsorpcia je vratná, lebo adsorbát je viazaný na povrch adsorbenta slabými medzimolekulovými silami.
Chemisorpcia
Pri chemisorpcii vzniká pevnejšia, najčastejšie elektrochemická väzba medzi adsorbovanou látkou a adsorbentom, pričom sa uvoľní teplo. Na rozdiel od fyzikálne adsorpcie prebieha chemisorpcia pomaly. Výťažok adsorpcie s rastúcou teplotou monotónne klesá.
...